Synthèse chimique de protéines natives, mutées, marquées
La production d’une protéine par voie biologique (expression par voie recombinante) est un procédé biotechnologique bien établi. Néanmoins, ces méthodes de production peuvent avoir de sérieuses limitations, dues à de nombreux problèmes comme la purification, l’agrégation, la toxicité de la protéine… De plus, la modification post translationnelle et l’incorporation d’acides aminés non naturels dans les protéines est compliquée.
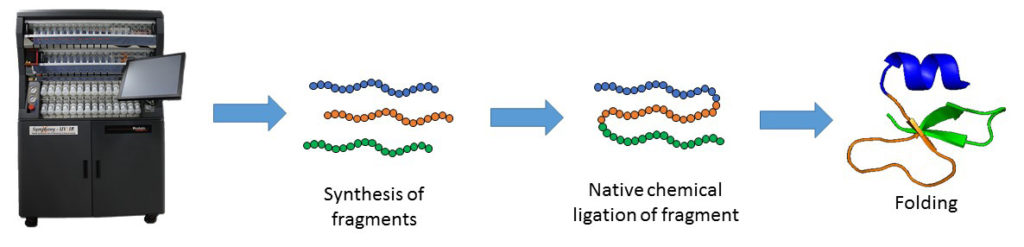
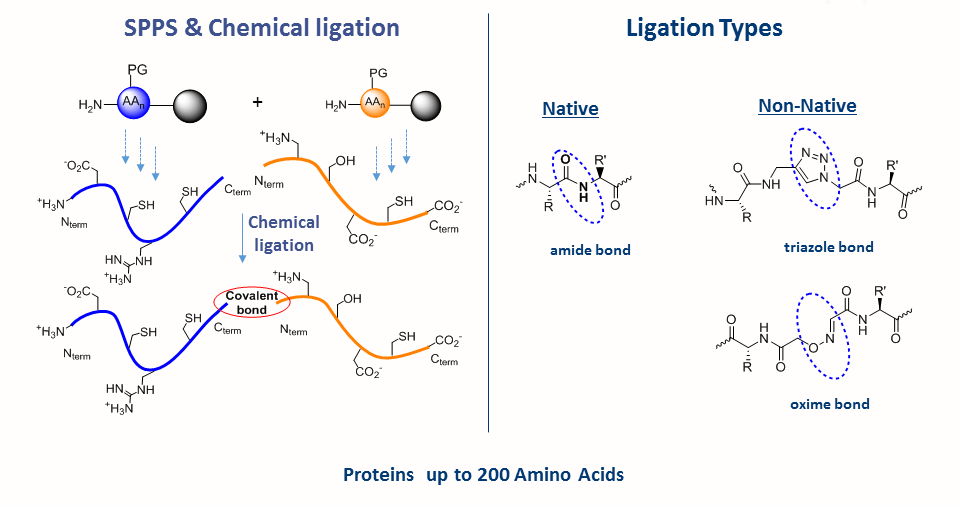
La synthèse de peptides en phase solide, développée dans les années 60 par Bruce Merrifield et qui sert de base pour la synthèse chimique de protéines, est la méthode de synthèse de peptides la plus efficace. Cette technique permet l’introduction directe d’acides aminés non naturels et les modifications post-traductionnelles (PTMs) dans la séquence du peptide.
Malgré ses nombreux avantages, la SPPS est limitée par la taille du peptide. Les peptides de plus de 50 résidus d’acides aminés sont souvent difficiles à synthétiser par SPPS. La principale avancée dans ce domaine fut la ligation chimique native, développée par les Laboratoires Kent. Elle permet la synthèse de chaines peptidiques plus longues. Cette approche chimique consiste à coupler des fragments de peptides non protégés : un peptide avec une cystéine en N-terminal réagit avec un peptide thioster en C-terminal. Cette étape de transthioesterification est très spécifique et se passe dans un tampon aqueux à pH neutre. La réaction est rapidement suivie par un déplacement intramoléculaire. S,N-acyl qui mène à la formation d’une liaison amide à l’endroit de la ligation. La NCL en conjugaison avec la SPPS peuvent être utilisées pour faire des protéines fonctionnelles.